Многие мембранные белки эукариотических клеток украшены сложными сахарными деревьями, называемыми гликанами. Эти сахарные деревья не только чрезвычайно разнообразны, но и служат способом идентификации соответствующего организма, типа клеток или стадии их зрелости. Например, разные группы крови у людей имеют разные гликаны.
Сложные сахара, связанные с липидами, образуют особый класс гликанов. В биологии они известны как связанные с липидами олигосахариды или LLO. LLO состоят из молекулы жира, встроенной в клеточную мембрану, и структуры сахара, которая простирается либо в просвет клеточных органелл, либо внеклеточно.
Исследователи из ETH Zurich, Университета Берна и Университета Чикаго выяснили структуру одного из ферментов, ответственных за формирование LLO. Их исследование только что было опубликовано в последнем номере журнала Nature.
Модульная белковая архитектура
Рассматриваемый фермент, известный как ALG6, принадлежит к суперсемейству ферментов, которые исследователи называют гликозилтрансферазами категории C. Встроенные в клеточные мембраны, они связывают простые молекулы сахара с другими сахарами для построения сахарных деревьев. Они также связывают молекулы сахара с белками. В этом качестве гликозилтрансферазы играют несколько ключевых биологических ролей во всех видах организмов, от бактерий и грибов до высокоразвитых млекопитающих.
Это надсемейство ферментов долгое время оставалось загадкой для биологов, поскольку его отдельные члены практически не имеют общих структурных мотивов. Единственное, что у них общего, это то, что они являются мембранными белками, которые переносят сахара от одной молекулы к другой, и что сахара, используемые для этого переноса, всегда присоединены к липидам.
Основываясь на структуре ALG6, группа, возглавляемая профессором ETH Каспаром Лохером, обнаружила, что члены этого семейства ферментов имеют модульную структуру. Их исследования показывают, что ALG6 и его родственники состоят из двух модулей: одного, структура которого сохраняется во время разработки, и второго, структурно изменчивого модуля.
«Мы считаем, что именно эта модульная конструкция помогла этим ферментам развиваться в разных направлениях и, в свою очередь, адаптироваться к большому количеству различных субстратов», - говорит Джоэль Блох, докторант ETH и ведущий автор исследования. исследование.
Выводы, наконец, объясняют механизм, лежащий в основе семейства ферментов. «Наше исследование имеет далеко идущие последствия для клеточной биологии и для производства терапевтических веществ на основе гликобиологии», - объясняет Блох. Эти идеи будут особенно ценны для инженерии антител, которая в настоящее время представляет большой интерес для фармацевтической промышленности. Они также будут полезны для производства индивидуальных гликанов в целом, которые важны для терапевтических белков, таких как антитела.
Рекорд в криоэлектронной микроскопии
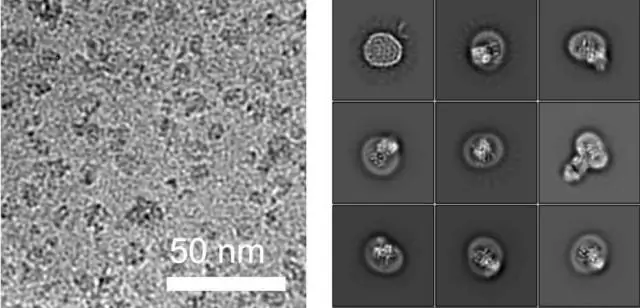
Исследователи также считают свои результаты прорывом в определении молекулярных структур белков с помощью криоэлектронной микроскопии (крио-ЭМ). В 2017 году швейцарский исследователь Жак Дюбоше получил Нобелевскую премию по химии за вклад в эту новаторскую технологию, которая с тех пор стала предпочтительным методом для изучения структуры больших молекулярных комплексов.
Определение структур небольших белков с высоким разрешением, особенно встроенных в мембраны, было невозможно с помощью крио-ЭМ, потому что измерения, проведенные для частиц с массой меньше определенной, не позволяют проводить точные структурные расчеты.
Работая вместе с исследовательской группой из Чикагского университета, команда ETH нашла решение этой проблемы. В сотрудничестве с исследователями из Чикаго они создали синтетическое антитело, которое связывается с ALG6. Это антитело увеличило массу фермента ALG6, так что его структуру можно было определить с высоким разрешением с помощью крио-ЭМ..
«Благодаря нашему подходу мы в настоящее время являемся мировым рекордсменом по наивысшему структурному разрешению, полученному для мембранно-связанного комплекса такого размера», - говорит Лочер с оттенком гордости. Он объясняет, что эти достижения в области крио-ЭМ позволят многим другим ученым выяснить структуру небольших мембранных белков: «Наш подход открывает научному сообществу путь к быстрому прогрессу в изучении мембранных белков, связанных с широким спектром заболеваний.."
Химио-ферментативный набор инструментов
Как будто этого было недостаточно, исследователи ETH в сотрудничестве с химиками из Бернского университета разработали методы синтеза очень сложных олигосахаридов, связанных с липидами, в лаборатории - то, что было невозможно с помощью обычных методы синтеза в органической химии.
В результате исследователи получили новое представление об основных клеточных путях биосинтеза LLO, что помогло им объяснить, как клетки строят сложные гликаны. «Это важная веха в гликобиологии, которая может стать основой для будущих исследований многих гликобиологов и для производства гликопротеинов», - говорит Лочер.