Исследователи Университета Брауна, изучающие биологию старения, продемонстрировали новую стратегию стимуляции аутофагии, процесса, посредством которого клетки восстанавливают себя, перерабатывая свои изношенные части.
В исследовании, опубликованном в журнале Cell Reports, исследователи показывают, что этот подход увеличивает продолжительность жизни червей и мух, а эксперименты на клетках человека намекают на то, что эта стратегия может быть полезна в будущем для лечения болезни Альцгеймера, БАС и другие возрастные нейродегенеративные состояния.
«Дисфункция аутофагии присутствует при целом ряде возрастных заболеваний, включая нейродегенерацию», - сказал Луи Лапьер, доцент кафедры молекулярной биологии, клеточной биологии и биохимии в Брауновском университете, который руководил работой.«Мы и другие думаем, что, научившись влиять на этот процесс фармакологически, мы могли бы повлиять на прогрессирование этих заболеваний. То, что мы показали здесь, - это новая и консервативная точка входа для стимуляции аутофагии».
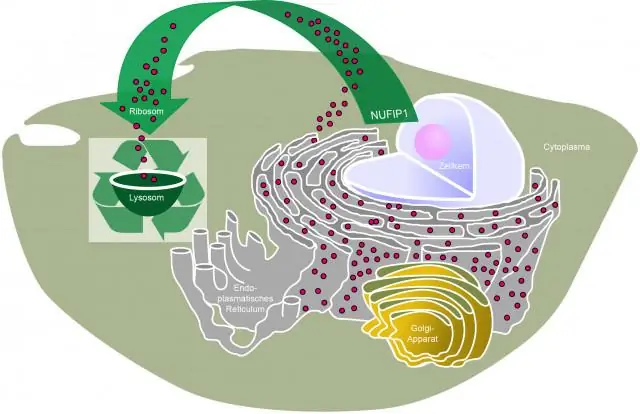
Аутофагия стала горячей темой в последние годы, за что ее первооткрыватель был удостоен Нобелевской премии по физиологии и медицине в 2016 году. Этот процесс включает в себя объединение неправильно свернутых белков и устаревших органелл внутри клетки в везикулы, называемые аутофагосомами. Затем аутофагосомы сливаются с лизосомой, ферментсодержащей органеллой, которая расщепляет эти клеточные макромолекулы и превращает их в компоненты, которые клетка может использовать повторно.
Лапьер и его коллеги хотели посмотреть, смогут ли они усилить аутофагию, манипулируя фактором транскрипции (белком, который включает и выключает экспрессию генов), который регулирует активность аутофагии. Чтобы фактор транскрипции включил аутофагическую активность, он должен быть локализован в ядре клетки. Итак, Лапьер и его команда провели скрининг генов, повышающих уровень транскрипционного фактора аутофагии, известного как TFEB, в ядрах.
Использование нематоды C. elegans показало, что снижение экспрессии белка под названием XPO1, который транспортирует белки из ядра, приводит к накоплению в ядре нематодной версии TFEB. Это накопление было связано с увеличением маркеров аутофагии, включая увеличение количества аутофагосом, аутолизосом, а также усиление биогенеза лизосом. Также наблюдалось заметное увеличение продолжительности жизни обработанных нематод примерно на 15-45 процентов.
«Мы показали, что, блокируя выход этого транскрипционного фактора из ядра, мы можем не только влиять на аутофагию, но и увеличивать продолжительность жизни», - сказал Лапьер.
Следующим шагом было выяснить, существуют ли препараты, которые могли бы имитировать эффект ингибирования генов, использованный в эксперименте по скринингу. Исследователи обнаружили, что селективные ингибиторы ядерного экспорта (SINE), изначально разработанные для ингибирования XPO1 для лечения рака, оказывали аналогичный эффект - повышали маркеры аутофагии и значительно увеличивали продолжительность жизни нематод.
Затем исследователи протестировали SINE на генетически модифицированной плодовой мушке, которая служит модельным организмом для нейродегенеративного заболевания БАС. Эти эксперименты показали небольшое, но значительное увеличение продолжительности жизни обработанных мух. «Наши данные свидетельствуют о том, что эти соединения могут частично облегчать нейродегенерацию у этих мух», - сказал Лапьер.
В качестве последнего шага исследователи решили выяснить, оказывает ли ингибирование XPO1 такое же влияние на аутофагию в клетках человека, как и у нематод. После обработки культуры клеток HeLa человека с помощью SINE исследователи обнаружили, что действительно увеличились концентрации TFEB в ядрах, а также маркеры аутофагической активности и лизосомального биогенеза..
«Наше исследование говорит нам, что регуляция внутриклеточного разделения TFEB сохраняется от нематод до человека и что SINE может стимулировать аутофагию у людей», - сказал Лапьер.«Недавно в клинических испытаниях было показано, что SINE переносится раком, поэтому существует потенциал для использования SINE для лечения других возрастных заболеваний».
По словам Лапьера, будущие исследования будут сосредоточены на тестировании этих препаратов на более клинически значимых моделях нейродегенеративных заболеваний. Но это первоначальное исследование является доказательством концепции этой стратегии как средства усиления аутофагии и потенциального лечения возрастных заболеваний.
Лапьер является преподавателем недавно утвержденного Центра биологии старения в Институте трансляционных наук Брауна. Этот центр под руководством профессора биологии Джона Седиви изучает биологические механизмы старения. Миссия центра состоит в расширении программ биомедицинских исследований и образовательных программ в новой дисциплине биогеронтологии, а также в совершении научных открытий, связанных со старением и связанными с ним расстройствами.