Исследование на мышах и людях показывает, что бактерии в кишечнике могут влиять на структуру кровеносных сосудов головного мозга и могут быть ответственны за возникновение пороков развития, которые могут привести к инсульту или эпилепсии. Исследование, опубликованное в журнале Nature, дополняет вырисовывающуюся картину, связывающую кишечные микробы и расстройства нервной системы. Исследование финансировалось Национальным институтом неврологических расстройств и инсульта (NINDS), входящим в состав Национального института здоровья (NIH).
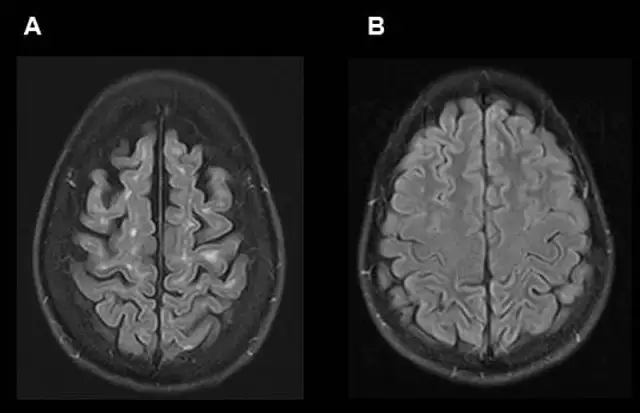
Церебральные кавернозные мальформации (СКМ) представляют собой скопления расширенных тонкостенных кровеносных сосудов, которые могут привести к судорогам или инсульту, когда кровь просачивается в окружающие ткани головного мозга. Группа ученых из Университета Пенсильвании исследовала механизмы, вызывающие образование поражений CCM у генетически модифицированных мышей, и обнаружила неожиданную связь с бактериями в кишечнике. Когда бактерии были устранены, количество поражений значительно уменьшилось.
«Это интересное исследование, поскольку оно показывает, что изменения в организме могут влиять на прогрессирование расстройства, вызванного генетической мутацией», - сказал Джим И. Кениг, доктор философии, программный директор NINDS.
Исследователи изучали хорошо зарекомендовавшую себя модель мыши, которая формирует значительное количество CCM после инъекции препарата, вызывающего делецию гена. Однако при переводе животных в новое помещение частота образования поражений снизилась практически до нуля.
«Это была полная загадка. Внезапно наша обычно надежная модель мыши больше не формировала поражения, которые мы ожидали», - сказал Марк Л. Кан, доктор медицинских наук, профессор медицины Пенсильванского университета и старший автор. исследования. «Интересно, что эта изменчивость в формировании поражений также наблюдается у людей, у которых пациенты с одной и той же генетической мутацией часто имеют совершенно разные течения заболевания».
Исследуя причину этой внезапной изменчивости, Алан Танг, аспирант лаборатории доктора Кана, заметил, что у нескольких мышей, у которых продолжали образовываться поражения, развились бактериальные абсцессы в брюшной полости - инфекции, которые, скорее всего, возникли из-за к абдоминальным инъекциям наркотиков. Абсцессы содержали грамотрицательные бактерии, и когда подобные бактериальные инфекции были преднамеренно вызваны у животных модели CCM, примерно у половины из них развились значительные CCM.
«У мышей, которые сформировали CCM, также были абсцессы в селезенке, что означало, что бактерии попали в кровоток из первоначального места абсцесса», - сказал Тан. «Это предполагает связь между распространением определенного типа бактерий через кровоток и образованием этих поражений кровеносных сосудов в головном мозге».
Оставался вопрос, как бактерии в крови могут влиять на поведение кровеносных сосудов в головном мозге. Грамотрицательные бактерии продуцируют молекулы, называемые липополисахаридами (ЛПС), которые являются мощными активаторами передачи сигналов врожденного иммунитета. Когда мышам вводили только LPS, у них образовывались многочисленные большие CCM, подобные тем, которые образуются при бактериальной инфекции. И наоборот, когда рецептор LPS, TLR4, был генетически удален у этих мышей, у них больше не образовывались поражения CCM. Исследователи также обнаружили, что у людей генетические мутации, вызывающие увеличение экспрессии TLR4, были связаны с повышенным риском формирования СКК.
«Мы знали, что образование поражений может быть вызвано грамотрицательными бактериями в организме посредством передачи сигналов LPS», - сказал Кан. «Наш следующий вопрос заключался в том, можем ли мы предотвратить поражения, изменив бактерии в организме».
Исследователи изучали изменения в бактериях (микробиоме) организма двумя способами. Во-первых, новорожденных мышей CCM выращивали либо в обычном помещении, либо в безмикробных условиях. Во-вторых, этим мышам дали курс антибиотиков, чтобы «перезагрузить» их микробиом. Как в безмикробных условиях, так и после курса антибиотиков количество поражений значительно уменьшилось, что указывает на то, что как количество, так и качество кишечного микробиома могут влиять на формирование ККМ. Наконец, лекарство, которое специфически блокирует TLR4, также приводило к значительному снижению образования повреждений. Этот препарат был протестирован в клинических испытаниях для лечения сепсиса, и эти результаты свидетельствуют о терапевтическом потенциале препарата при лечении CCM, хотя еще предстоит провести значительные исследования.
«Эти результаты особенно интересны, потому что они показывают, что мы можем получить результаты, полученные на мышах, и, возможно, применить их к популяции пациентов», - сказал Кениг. «Препарат, используемый для блокирования TLR4, уже был протестирован на пациентах с другими состояниями, и он может показать терапевтический потенциал в лечении CCM, хотя еще предстоит провести значительные исследования».
Кан и его коллеги планируют продолжить изучение взаимосвязи между микробиомом и формированием CCM, особенно в том, что касается болезней человека. Хотя у людей были идентифицированы специфические генные мутации, которые могут вызывать формирование СКК, их размер и количество широко различаются у пациентов с одними и теми же мутациями. Затем группа стремится проверить гипотезу о том, что различия в микробиомах пациентов могут объяснить эту изменчивость в количестве поражений.