Шапероны - это специализированные белки в клетке, которые помогают другим белкам достигать их функциональных трехмерных форм, которые соответствуют состояниям, предпочитаемым при термодинамическом равновесии. Но новое исследование, проведенное учеными EPFL, UNIL и INSERM (Франция), показывает, что шапероны также могут поддерживать белки в неравновесном состоянии, потенциально изменяя их судьбу. Работа опубликована в Nature Chemical Biology.
После трансляции белки должны сворачиваться в свою функциональную трехмерную форму и сохранять ее, подвергаясь воздействию различных возмущений: внешних стрессов, таких как перепады температуры, неправильное взаимодействие с другими белками в клетке и даже вредные мутации. Чтобы белки оставались функциональными, клетка использует особый класс белков - шапероны. Они присутствуют во всех организмах и являются одними из самых распространенных белков в клетках, что подчеркивает их важность для поддержания жизни.
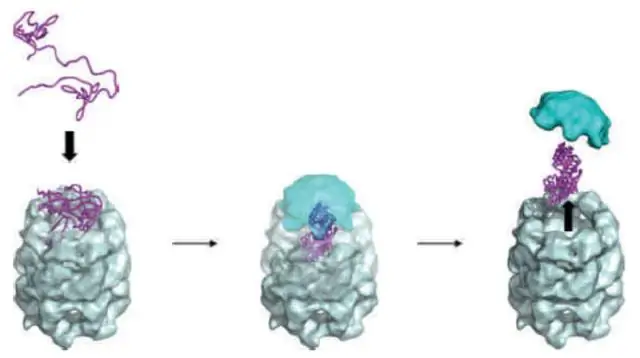
Современная точка зрения состоит в том, что функциональная трехмерная форма белка также является его наиболее термодинамически стабильным состоянием, и что шапероны помогают белкам достичь этого состояния, удерживая их от агрегации и позволяя им избежать так называемых «кинетических ловушек». - точки, в которых белок может «застрять» в нефункциональном состоянии. И для всего этого шаперонам нужна энергия, которая поступает в клетку в виде аденозинтрифосфата, или АТФ..
Лаборатории Паоло Де Лос-Риоса в EPFL и Пьера Голубинова в UNIL в сотрудничестве с Алессандро Бардуччи (INSERM, Монпелье) показали, что энергия АТФ используется шаперонами для активного поддержания белков, с которыми они работают. в неравновесном, но временно устойчивом варианте функциональной формы даже в условиях, при которых функциональная форма не должна быть термодинамически стабильной.
«Мы обнаружили, что шапероны могут активно восстанавливать и возвращать белки, на которые они воздействуют, в неравновесном стационарном состоянии», - говорит Де Лос Риос. «В этом состоянии белки находятся в своем нативном состоянии, даже если с точки зрения равновесной термодинамики это не так».
Исследователи объединили теоретические и экспериментальные подходы, чтобы доказать, что шапероны являются молекулярными моторами, способными выполнять работу и расширять диапазон стабильности белков. Полученные результаты могут подвергнуть сомнению часть распространенного мнения о том, что эволюция спроектировала аминокислотные последовательности таким образом, что функциональное состояние белка, к которому они принадлежат, является термодинамически оптимальным.
«В присутствии шаперонов даже термодинамически субоптимальные белки могут достичь своей функциональной формы, способствуя эволюции в ее бесконечных исследованиях химических возможностей», - говорит Де Лос Риос..