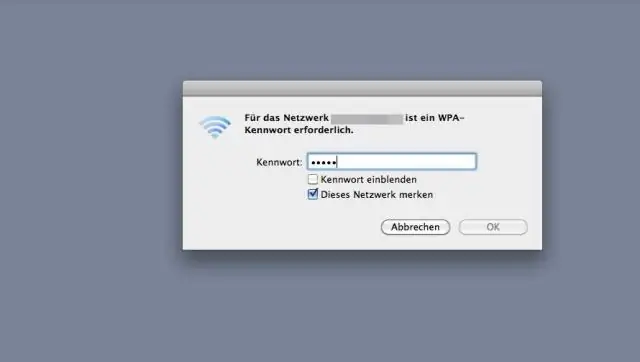
Используя белки, полученные из медуз, ученые собрали сложную структуру из шестнадцати белков, состоящую из двух сложенных друг на друга октамеров. Это исследование может быть применено к полезным технологиям, таким как фармацевтическое нацеливание, сбор искусственной энергии, «умные» датчики и строительные материалы и многое другое. Вычислительное моделирование с помощью распределений XSEDE на Stampede2 (TACC) и Comet (SDSC) позволило уточнить измерения структуры.
Красные кровяные тельца удивительны. Они забирают кислород из наших легких и разносят его по всему телу, поддерживая нашу жизнь. Молекула гемоглобина в эритроцитах переносит кислород, изменяя свою форму по принципу «все или ничего». Четыре копии одного и того же белка в гемоглобине открываются и закрываются, как лепестки цветка, структурно связанные, чтобы реагировать друг на друга. Используя суперкомпьютеры, ученые только начинают разрабатывать белки, которые самособираются, объединяясь и напоминая живительные молекулы, такие как гемоглобин. Ученые говорят, что их методы могут быть применены к полезным технологиям, таким как фармацевтическое нацеливание, сбор искусственной энергии, «умные» датчики и строительные материалы и многое другое.
Научная группа проделала эту работу, перегрузив белки, что означает, что они изменили субъединицы белков, аминокислоты, чтобы придать белкам искусственно высокий положительный или отрицательный заряд. Используя белки, полученные из медуз, ученые смогли собрать сложную структуру из шестнадцати белков, состоящую из двух сложенных друг на друга октамеров, только за счет сверхзарядки, результаты, о которых сообщалось в январе 2019 года в журнале Nature Chemistry.
Затем команда использовала моделирование на суперкомпьютере для проверки и информирования об этих экспериментальных результатах. Распределения суперкомпьютеров на Stampede2 в Техасском центре передовых вычислений (TACC) и Comet в Суперкомпьютерном центре Сан-Диего (SDSC) были предоставлены исследователям через XSEDE, Среду экстремальных научных и инженерных открытий, финансируемую Национальным научным фондом (NSF).
«Мы обнаружили, что, беря белки, которые обычно не взаимодействуют друг с другом, мы можем создавать копии, которые либо сильно положительно, либо сильно отрицательно заряжены», - сказала соавтор исследования Анна Саймон, научный сотрудник с докторской степенью. Эллингтон Лаборатория UT Austin. «Сочетая сильно положительно и отрицательно заряженные копии, мы можем заставить белки собираться в очень специфические структурированные сборки», - сказал Саймон. Ученые называют свою стратегию «сборкой сверхзаряженных белков», когда они управляют определенными белковыми взаимодействиями, комбинируя сконструированные сверхзаряженные варианты.
"Мы использовали очень известный и основной принцип природы, что противоположные заряды притягиваются", - добавил соавтор исследования Йенс Глейзер. Глейзер - ассистент научного сотрудника в Glotzer Group, факультет химического машиностроения Мичиганского университета. «Группа Анны Саймон обнаружила, что когда они смешивают эти заряженные варианты зеленого флуоресцентного белка, они получают высокоупорядоченные структуры. Это было настоящим сюрпризом», - сказал Глейзер.
Сложенная октамерная структура выглядит как плетеное кольцо. Он состоит из 16 белков - двух переплетенных колец по восемь, которые взаимодействуют в очень специфических дискретных участках. «Причина, по которой так сложно создавать синтетически взаимодействующие белки, заключается в том, что очень сложно создать эти взаимодействующие участки и выровнять их все так, чтобы они позволили белкам собираться в более крупные, регулярные структуры», - объяснил Саймон. Они решили эту проблему, добавив много положительных и отрицательных зарядов к инженерным вариантам зеленого флуоресцентного белка (GFP), хорошо изученного белка «лабораторной мыши», полученного из медузы Aequorea victoria.
Положительно заряженный белок, который они назвали лазурным флуоресцентным белком (Ceru) +32, имел дополнительные возможности взаимодействовать с отрицательно заряженным белком GFP-17. «Предоставив этим белкам все эти возможности, эти различные места, где они могли потенциально взаимодействовать, они смогли выбрать правильные», - сказал Саймон. «Были определенные паттерны и взаимодействия, которые были доступны и энергетически благоприятны, которые мы не обязательно предсказывали заранее, что позволило бы им собраться в эти конкретные формы».
Чтобы получить сконструированные заряженные флуоресцентные белки, Саймон и его соавторы Арти Потукучи, Джимми Голлихар и Барретт Морроу закодировали свои гены, в том числе химическую метку, используемую для очистки портативных фрагментов ДНК, называемых плазмидами в E. coli, затем собирали меченый белок, который выращивала E. coli. Ученые смешали белки вместе. Первоначально они думали, что белки могут просто взаимодействовать, образуя большие нерегулярно структурированные скопления.«Но затем мы продолжали наблюдать этот странный, забавный пик около 12 нанометров, который был намного меньше, чем большой комок белка, но значительно больше, чем отдельный белок», - сказал Саймон..
Они измерили размер образовавшихся частиц с помощью прибора Zetasizer в Техасском институте материалов штата Юта, Остин, и подтвердили, что частицы содержат как церулеановые, так и GFP белки Резонансная передача энергии Ферстера (FRET), которая измеряет энергию перенос между разноцветными флуоресцентными белками вызывает флуоресценцию в ответ на разные энергии света, чтобы увидеть, находятся ли они близко друг к другу. Электронная микроскопия с отрицательным окрашиванием определила специфическую структуру частиц, проведенная группой Дэвида Тейлора, доцента кафедры молекулярной биологии в UT Austin. Это показало, что частица размером 12 нм состоит из сложенного октамера, состоящего из шестнадцати белков. «Мы обнаружили, что это были структуры, похожие на цветы красивой формы», - сказал Саймон. Соавтор Йи Чжоу из группы Тейлора из UT Austin еще больше увеличил разрешение, используя криоэлектронную микроскопию, чтобы выявить детали многослойного октамера на атомном уровне.
Компьютерное моделирование улучшило измерения того, как белки были организованы, в четкую картину красивой, похожей на цветок структуры, по словам Йенса Глейзера. «Нам нужно было придумать модель, которая была бы достаточно сложной, чтобы описать физику заряженных зеленых флуоресцентных белков и представить все соответствующие атомистические детали, но была бы достаточно эффективной, чтобы позволить нам смоделировать это в реалистичном временном масштабе. С полностью атомистической моделью. модели, нам потребовалось бы больше года, чтобы получить одну симуляцию из компьютера, каким бы быстрым ни был компьютер», - сказал Глейзер.
Они упростили модель, уменьшив разрешение, не жертвуя важными деталями взаимодействия между белками. «Вот почему мы использовали модель, в которой форма белка точно представлена молекулярной поверхностью, точно так же, как та, которая измеряется по кристаллографической структуре белка», - добавил Глейзер.
«Что действительно помогло нам изменить ситуацию и улучшить то, что мы смогли получить из наших симуляций, так это данные крио-ЭМ», - сказал Вьяс Рамасубрамани, аспирант химического машиностроения Мичиганского университета. «Это то, что действительно помогло нам найти оптимальную конфигурацию для этих симуляций, что затем помогло нам подтвердить аргументы стабильности, которые мы приводили, и, надеюсь, в будущем сделать прогнозы о том, как мы можем дестабилизировать или изменить эту структуру», - сказал Рамасубрамани.
Ученым требовалось много вычислительной мощности, чтобы выполнять расчеты в желаемом масштабе.
Мы использовали XSEDE, чтобы в основном взять эти огромные системы, в которых есть много разных частей, взаимодействующих друг с другом, и рассчитать все это сразу, чтобы, когда вы начнете продвигать свою систему вперед через какое-то подобие времени, вы могли бы получить представление о том, как это будет развиваться в несколько реальных масштабах времени», - сказал Рамасубрамани.«Если бы вы попытались провести такое же моделирование, как мы, на ноутбуке, то потребовались бы месяцы, если не годы, чтобы действительно приблизиться к пониманию того, будет ли какая-то структура стабильной. Для нас неспособность использовать XSEDE, где вы могли бы использовать по существу 48 ядер, 48 вычислительных блоков одновременно, чтобы сделать эти вычисления высокопараллельными, мы бы делали это намного медленнее».
Суперкомпьютер Stampede2 в TACC содержит 4 200 вычислительных узлов Intel Knights Landing и 1 736 вычислительных узлов Intel Skylake X. Каждый узел Skylake имеет 48 ядер, базовую единицу компьютерного процессора. «Узлы Skylake суперкомпьютера Stampede2 сыграли важную роль в достижении производительности, необходимой для эффективного расчета этих электростатических взаимодействий между противоположно заряженными белками», - сказал Глейзер. «Появление суперкомпьютера Stampede2 было для нас как раз подходящим моментом для выполнения этих симуляций."
Первоначально научная группа тестировала свои модели на системе Кометы в SDSC. «Когда мы впервые выясняли, какую модель использовать и даст ли эта упрощенная модель разумные результаты, Comet была отличным местом, чтобы попробовать эти симуляции», - сказал Рамасубрамани. «Комета была отличной испытательной площадкой для того, что мы делали».
Глядя на более широкую научную картину, ученые надеются, что эта работа продвинет понимание того, почему так много белков в природе олигомеризуются или соединяются вместе, образуя более сложные и интересные структуры.
«Мы показали, что для формирования этих структур не обязательно должен быть очень конкретный, заранее выделенный набор планов и взаимодействий», - сказал Саймон. «Это важно, потому что это означает, что, возможно, и весьма вероятно, мы можем взять другие наборы молекул, которые мы хотим заставить олигомеризоваться, и генерировать как положительно заряженные, так и отрицательно заряженные варианты, комбинировать их и иметь для них специально упорядоченные структуры."
Природные биоматериалы, такие как кости, перья и панцири, могут быть прочными, но легкими. «Мы думаем, что сборка суперзаряженного белка - это более простой способ разработки материалов, обладающих потрясающими синтетическими свойствами, без необходимости тратить так много времени или заранее знать, как они собираются вместе», - сказал Саймон. «Мы думаем, что это ускорит разработку синтетических материалов, а также открытие и исследование этих наноструктурированных белковых материалов».